hәllolmuş maddә molekullarının kation vә ani onlara tam vә ya qismәn parçalanması. İon kristallarının hәll olduqda vә ya әridikdә kation vә anionlara parçalanması da E.d. adlanır. E.d. bir qayda olaraq daha
polyar hәlledicilәrdә baş verir. Bu proses zamanı adәtәn molekulun yalnız daha polyar rabitәsi qırılır, mәs., karbon turşuları (RCOOH) RCOO– vә H+ ion la rına dissosiasiya edir. Bәzi hәlledicilәrin (mәs., suyun) molekulları E.d.-ya uğraya bilәr. E.d. әsasәn hәllolan maddәnin hәlledici ilә qarşılıqlı tәsiri (bu, ionların solvatlaşmasına gәtirir) vә mühitdәki solvatlaşmış ionlar arasında elektrostatik qarşılıqlı tәsirin, hәlledicinin elektrostatik sahәsi (dielektrik nüfuzluğu) hesabına xeyli zәiflәmәsi nәticәsindә baş verir. Bu zaman molekulların (kristal qәfәsinin) da ğılması üçün lazım olan iş solvatlaşma enerjisi hesabına görülür. E.d. әsa sında mәhlullar iki sinfә ayrılır: qeyri-elektrolit vә elektrolit mәhlullar. Elektrolit vә qeyri-elektrolitlәrin duru mәhlullarının kolliqativ xassәlәri arasında fәrqlәr mәhlul da E.d. zamanı hissәciklәrin ümumi sayının artmasına görә yaranır. Bu, mәs., qeyri-elek trolitlәrin mәhlulları ilә müqayisәdә mәhlulun osmos tәzyiqinin yüksәlmәsinә, mәhlul üzәrindә hәlledici buxarı tәzyiqinin azalmasına, tәmiz hәllediciyә nisbәtәn mәhlulun qaynama vә donma temp-r dәyişmәlәrinin artmasına gәtirib çıxarır.
Elektrolitlәrin ion keçiriciliyinin sәbәbi dә E.d.-dır. E.d. miqdarca dissosiasiya dәrәcәsi a ilә xarakterizә olunur; α – elektrolitin ionlara dissosiasiya etmiş molekullarının sayının mәhluldakı molekulların ilkin sayına olan nisbәtidir. Buna görә α 0-dan (dissosiasiya baş vermir) 1-ә qәdәr (tam dissosiasiya) dәyişir, hәllolan maddәnin vә hәlledicinin tәbiәtindәn, hәmçinin mәhlulun qatılığı vә temp-rdan asılıdır. Әsasәn, hәlledicinin dielektrik nüfuzluğunun e artması ilә α artır, e bәzi hәlledicilәrdә kiçik olmasına baxmayaraq dissosiasiya nәzәrә çarpacaq dәrәcәdә müşahidә edilir. MX maddәsinin müәyyәn hәlledicidә MX M++X– sxemi üzrә dissosiasiya qabiliyyәti dissosiasiya sabiti KD ilә göstәrilir. Kütlәlәrin tәsiri qanununa görә KD ilә α arasındakı әlaqә aşağıdakı kimidir:
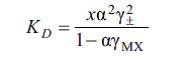
Burada, χ– elektrolitin molyar qatılığı; γ± – aktivliyin orta ion әmsalı; γMX –elektrolitin dissosiasiya etmәmiş hissәsinin aktivlik әmsalıdır. KD – hәllolan maddәnin xassәlәrindәn, o cümlәdәn elektrolitin ka -
tion vә anion әmәlә gәtirәn fraqmentlәri arasındakı әlaqәnin davamlığından, hәlledicinin dielektrik xassәlәrindәn vә onun ionları solvatlaşdırma qabiliyyәtindәn, habelә temp-r vә tәzyiqdәn asılıdır; α-dan fәrqli olaraq mәhlulun qatı lığından asılı deyildir. Dissosiasiya sabitini (KD) tәcrübi yolla, mәs., mәhlulun elektrik keçiriciliyinin elektrolitin qatılığından asılılğına görә vә ya mәhlulda sәrbәst ionların miqdarını birbaşa ölçmәklә (mәs., spektrofotometrik üsulla) tәyin etmәk olar. Tam vә natamam E.d. anlayışına müvafiq olaraq elektrolitlәr şәrti olaraq qüvvәtli α ≈1 vә zәif α <<1elektrolitlәrә ayrılır (bax Elektrolitlәr). Zәif elektrolitlәrin duru mәhlulları öz xassәlәrinә görә ideal mәhlullara yaxındır vә onlar üçün (1) tәnliyindә aktivlik әmsalını vahid qәbul etmәk olar; bu halda (1) tәnliyi Ostvaldın durulaşma qanununa çevrilir:
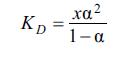
α-nı λ/λ∞ nisbәti ilә әvәz etmәk olar; λ, λ∞ verilmiş qatılıqda vә sonsuz durulaşdır ıldıqda mәhlulun müvafiq ekvivalent elektrik keçiriciliyidir. Ostvald qanununa görә mәhlulun qatılığı azal dıqca dissosiasiya dәrәcәsi vә ekvivalent keçiriciliyi artır, sonsuz durulaşmada α→1 vә λ→λ∞ olur. Qüvvәtli elektrolitlәr ideal mәhlullar olmadığından onları tәsvir etmәk üçün ionlararası qarşılıqlı tәsir nәzәrә alınmalıdır. E.d. anlayışı 1887 ildә S. Arrenius tәrәfindәn verilmişdir. E.d. elektrolit mәh lul la rın hәm xassәlәrini, hәm dә onlarda gedәn proseslәrin xüsusiyyәtlәrini müәyyәn etmәklә bir sıra tәbii vә istehsal proseslәrindә mühüm rol oynayır.
Әd.: И з м а й л о в Н.А. Электрохимия растворов. 3 изд. М., 1976.














